A talajkolloid szilárd-szervetlen fázisai anyagösszetétel szempontjából – bár döntően rétegszilikát agyagásványok – jelentős mértékben hidroxidok, oxi-hidroxidok, valamint amorf szilikátos és oxidos anyagok. A szilikátos kristályos és amorf fázisok közötti átmentként értelmezhetjük az allofán és imogolit nevű ásványokat, melyek jellemző szemcse- és aggregátummérete is 10 nanométer alatti, és a többi fázis mérete is döntően a 100 nm alatti tartományban van, részlegesen pedig elérheti a több száz nanométert is.
Makro- és mikronutriensek
A mikrométeres és kissé nagyobb részecskék is a kolloid részének tekinthetők, műszaki definíciók szerint is, de több alapvető tényezőben is különbözni fognak a nanofrakciótól: kisebb fajlagos felület, alacsonyabb felületi töltés, amiből ráadásul kevesebb a pozitív töltés. Márpedig az olyan alapvető makronutriensek, mint a kén, foszfor, nitrogén vagy a mikronutriensek, mint a bór, szelén, klór, bróm stb. elérhetővé tételében, szállításában és raktározásában ezeknek a pozitív felületi töltéseknek jelentős szerepük van. Ezek ugyanis nem elemi oldott formában vannak jelen, hanem oxianionok hidrátkomplexeiben – kioldódási és mikrobiálisan feldolgozott formájukban is –, amelyek szerves molekulákba való beépülésüket és/vagy bioabszorbciójukat megelőzően a kolloidszemcsék felületén léteznek. Ilyen szempontból pedig kevésbé előnyös a helyzetük, mint az oldott kationoké, mivel az ásványi szemcsék felületi töltése túlnyomórészt negatív.
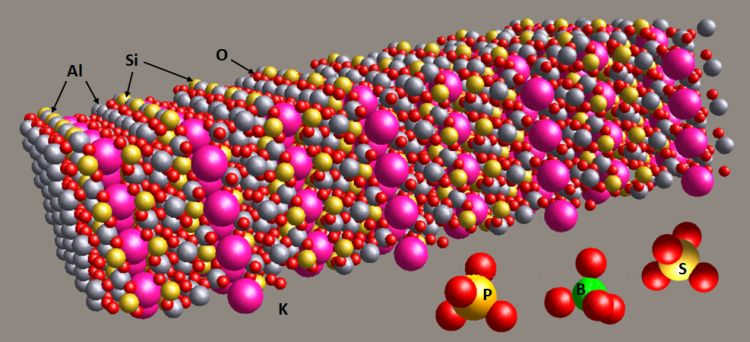
A huminsav és származékai, az oldott szerves komponensek szintén negatív töltésűek, és az oxidos kolloidrészecskék felületén kötődnek, illetve az oldott fémek forgalmában töltenek be alapvető funkciót a kelátképzés során. A negatív töltés miatt a felületi adszorpció kompetitív lehet az anionok és szerves komponensek között, de a jelenség olyan szempontból kevésbé jelentős, hogy az oxianionok hidrátkomplexei további komplexeket képeznek a szerves molekulákkal és ásványi felületekkel a talajkolloidban eltöltött élettartamukra.
A foszfor oldott szervetlen formája, a foszfát anion [PO4]3-, tetraéderes koordinációban, amelynek ásványai bár gyakoriak (kb. 600 a 6000-ből), forrása főleg az apatit (csoport) Ca5 (PO4)3 (OH, F, Cl), kisebb mértékben ritkaföldfémek vagy Al + egyéb fémek foszfátásványai, általános képlettel MAl3(PO4)2-y (SO4)2-y (OH, H2O)6, ahol M lehet Ca, Sr, de akár Ba vagy Pb is. Mivel ezek eredendő ásványi aránya a termőtalajban százalék alatti, ami egyébként a természetesen adaptálódott növényzet számára elegendő, így lényegesen fontosabb a szerves, biológiai formából reciklált foszfát: ürülék (főleg madarak) és elhalt növényi anyag, úgy a levelek, mint a gyökérzet és szimbiótái. Az ammónium magnézium foszfát, amit ásványi néven struvitként NH4MgPO46H2O is ismerünk, egy ideális anyag a makronutriensek szempontjából, szintetizálható, de ipari melléktermékként is termelődik, illetve környezetvédelmi folyamatok során szintetizálható.
Szulfát és szulfit
Szulfátnak nevezzük a tetraéderesen koordinált kén oxi-aniont [SO4]2-, amely direkt módon ásványokból (575 a 6000-ből) is kioldódhat, mégis a bakteriális folyamatok szabadítják fel inkább, vagy ugyancsak baktériumok, esetleg felületi red-ox reakciók segítségével az ásványi S-ből, szulfidokból és szerves S-forrásokból képződik. Bár ásványai gyakoribbak a termőtalajokban, a foszforhoz hasonlóan kiemelkedő a szerves visszaforgatott szulfátarány jelentősége. A kén szulfit [SO3]2- típusú formája, bár jelen van ásványokban és a talajkolloidban is, a bioabszorbcióhoz ez is szulfáttá oxidálódik bakteriálisan. A leggyakoribb ásványi szulfáttrágya a gipsz CaSO42H2O, amelynek nemcsak bányászott formáját, hanem a füstgáz kénmentesítésből keletkező mikronos por változatát is alkalmazzák, nyilván a nehézfém és egyéb mérgező elemek megfelelően alacsony koncentrációinál. A terméskén és kőolaj-finomítói kén szulfátkonverzió után vagy önmagában is alkalmas a műtrágyákban, de számos ipari mellékterméket (másodnyersanyagot) mint vízben oldható szulfátforrást is használunk. A többlépcsős ionos konverzió lehetőséget ad olyan anyagok szintetizálására is, mint a polihalit K2Ca2Mg (SO4)4 x 2H2O nevű ásvány, amely a természetben a sókőzetekben is lehet gyakori, így vizes oldatból kristályosítani is viszonylag egyszerű.
A nitrát és a bór
A nitrogén biológiailag hasznosuló ásványi formájának, a nitrátnak [NO3]1- rendkívül ritkák az ásványai (19 a 6000-ből), csak a sivatagi időszakos vizek talajaiban van ásványi forrása, mivel még a szikes talajokban is a bakteriálisan termelt nitrátot kötik meg a kationok, hogy például salétrom- (alfa-KNO3) kivirágzás képződjön. Sőt, a nitrátkonverzió alapjául szolgáló ammónia- és ammóniumvegyületek forrása is szerves, de ezek kipárolgásának megelőzését is az ásványi szemcsék abszorbeáló hatása biztosítja. Természetes ásványi forrásból nitráttrágyát csak a Chilei-salétromként is ismert nitratin nevű NaNO3-ot találjuk, de ennek a mezőgazdasági alkalmazása nem reális. Ipari termékként az NH4NO3 helyett a Ca és Mg, esetleg K-nitrátokat alkalmazzuk.
A bór oldott formában a borát anion alakjában található meg, és a talajokban nem fordul elő saját ásványaiban; kimutatható mennyisége 0,03–0,005 tömegszázalék. Ásványai (kb. 100 a 6000-ből) – bár kiterjedt telepeket is alkotnak – ritkán fordulnak elő, és a kőzetekben arányuk elenyésző. Mivel a termőtalajokban főleg a baktérium/gomba-növény biológiai kölcsönhatásokért felelős mikrotápelem, amely egyúttal meg is mérgezi a mikrobiális közösséget, ezért mennyisége egyike a legkritikusabb talajparamétereknek. A bórkivonásra iparilag hasznosított ásványok, például a colemanit Ca2B6O11 x 5H2O, ulexit NaCaB509.8H2O vagy boracit Mg3B7O13Cl, amelyek önmagukban is kiváló ásványi trágyák – lehetnek. Hiszen az esszenciális kationokat, akár egyéb anionokat is hordoznak, és bár vízoldhatóságuk ugyan magas, de ezt a kationok típusával és arányával szabályozni lehet.
Kevés, de fontos
A szelenát [SeO4]2- és szelenit [SeO3]2- anionok mint a szelén mobilizálható és elérhető formái, még a borátoknál is kevesebb (22 a 6000-ből) ásványfajjal jelennek meg, így a Se talajokban lévő koncentrációja is az ezredszázalék alatt van. Talán ennek is tulajdonítható, hogy még mikronutriensként sem esszenciális, de jelenléte nagymértékben csökkenti a növényeket érő nem biológiai stresszhatásokat, mint az aszály vagy extrém hőmérsékletváltozás.
A halogénionok mindegyike fontos szerepet játszik a növényi és ahhoz kapcsolódó talajélet metabolikus folyamataiban, különböző szinteken. Míg a klóridion Cl1- a zöldtömeg növekedésben és vízháztartásban fontos makronutriens, addig a jódidion I1– a proteinek megfelelő képződéséhez szükséges mikronutriens. A jódhoz hasonló szerepet játszik a bróm is, és mindkettő esetében a néhány század tömegszázalékos felvétel a növényi szövetek károsodásához vezet, a fejlődést és növekedést mérgező mikroelemekké válnak. A halogének ásványi formában való jelenléte vagy akár bevitele általában talajkárosító, ezeket az ásványokat általánosan sóknak is hívjuk – analógiában a sóval, mint NaCl és annak hatásaival. A szikes talajok a szulfát- és nitrátsókon kívül halogenidsókat is tartalmaznak, tehát a talajok „sózása” elsősorban szikesedéshez vezetne, nemcsak az anionok, de az alkáli kationok jelenléte miatt is. Ennek ellenére a szilvin nevű KCl, azaz kálisó a leggyakoribb klór- és egyben káliumtrágya, és egyben a NaCl mellett ez a Cl ásványi, bányászható forrásának második leggyakoribb képviselője. A karnalit KMgCl3 x 6H2O általában kíséri a kálisót ásványi telepeiben, és alkalmazzák is mint klórtrágyát, bár a magas víztartalma miatt tárolása és szilárd formában való tartása problémás.
Szilikát, szilícium
Felmerülhet a kérdés, hogy a Si forrását, a szilikát- [SiO4]4- aniont vagy a karbonát- [CO3]2- aniont mint szénforrást miért nem érintette a korábbi rövid ismertetés? Az összefoglaló szempontjából viszonylag egyszerűek a válaszok. A szilikát és szilícium eleve meghatározó alkotója a talajkolloidnak és tápanyagforgalomnak például a szerves komponensek felvétele, tárolása és leadása szempontjából is. A karbonátanion pedig, bármennyire is esszenciális része a talajéletnek, nem szénforrásként, hanem a talajkolloid rendszer fiziko-kémiai stabilitásáért felel, például a hidrogénkarbonát pH-szabályozó funkciója által, ami a kationok ásványi rácsból, felületről való leoldását vagy kötését határozza meg. A két anion szinergiája rendkívüli: az oldott monomer [SiO4]4- hidrátkomplexben savként viselkedik (kovasav), a kioldási forrásként szolgáló szilikátásványok viszont oldhatósága savas közegben javul. Nyilván itt a szerves savaknak is van jelentősége, de az elsődleges „savanyító” a hidratált [CO3]2- anion, amit viszont csak az esővíz és oxidatívan bomló szerves anyagok tudnak szolgáltatni. Ugyanis a talajsavanyodás megfordítására bevitt meszezőanyagok, amennyiben karbonátos összetételűek, nem szabadítanak fel oldható karbonátiont. Sőt, ellenkezőleg, a savanyú kémhatás csökkentése az oldott karbonát ásványi megkötését is magába foglalja, miközben az oldott szilikát mennyisége is csökken.

A jelen és a jövő trágyái
Az anion típusú, nemfémes tápelemek rövid ismertetése után egyértelműnek tűnhet, hogy ezek pótlása szerves trágyával, szerves mátrixú mesterséges készítményekkel lehet célszerű, főként, hogy az ásványi forrásból csak mikrobiális átalakítás után lesznek felvehető formájúak. A felvetés pedig helyes lehet, ha a rövid idejű hozamnövelés a célunk, és az ásványi -> szerves átalakítási folyamatok idejét kiiktatjuk a talajéletből. De a hosszabb távú, pl. több éven át tartó hatás nehezen kivitelezhető csak szerves formában, az anionok ásványi formái nem képződnek a talajban, vagy ha igen, az nagymértékű túltengésből következő kicsapódást jelent. Ráadásul a vízoldható ásványi pótlóanyagok, főként a borát és halogenidek esetében kihívást jelent a mikrogrammok optimális beállítása, hiszen a talajélet szempontjából kijuttatás után azonnal elérhetővé válnak a komponensek, hirtelen növénymérgezést vagy talajszennyezést okozva, amennyiben nincs teljes biológiai hasznosulás.
Összegzésként felvethetjük az ötletet, hogy a jövő ásványi trágyája egy komplex ammónium- és halogéntartalmú szulfát-foszfát, olyan szilikáthordo(zón/ban), amely intersticiálisan vagy felületen kemiszorpcióval hordozza a nitrátot, esetleg borátot. Addig viszont használjuk a bányászott porokat vagy azok szintetikus termékeit, reménykedve az ipari melléktermékek hasznosításában, amint a gazdasági környezet mindezt lehetővé teszi.
Dr. Kristály Ferenc
Miskolci Egyetem





![a_valodi_talaj_es_levelen_keresztuli_hatasu_repce_oszi_g[1]](https://agraragazat.hu/wp-content/uploads/2018/08/a_valodi_talaj_es_levelen_keresztuli_hatasu_repce_oszi_g1-375x216.jpg)
![sikeres_amatechnica_2018_kiallitas_eros_bel_es_kulfoldi_[1]](https://agraragazat.hu/wp-content/uploads/2018/07/sikeres_amatechnica_2018_kiallitas_eros_bel_es_kulfoldi_1-375x250.jpg)
![stock_photo_225[1]](https://agraragazat.hu/wp-content/uploads/2019/08/stock_photo_2251-375x188.jpg)

